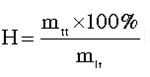Trong bài viết dưới đây, chúng tôi sẽ hướng dẫn các bạn cách viết và cân bằng phương trình phản ứng oxy hóa khử Zn + HNO3 → Zn(NO3)2 + NO + H2O cực đơn giản để các bạn cùng tham khảo nhé.

Nội dung bài viết
Zn + HNO3 loãng tạo ra chất gì?
3Zn + 8HNO3 → 3Zn(NO3)2 + 2NO + 4H2O
1. Điều kiện phản ứng giữa Zn và dung dịch HNO3 loãng
Không có
2. Các thực hiện phản ứng Zn và dung dịch HNO3 loãng
Cho mẫu kẽm bỏ vào ống nghiệm, sau đó cho vài giọt dung dịch HNO3 vào ống nghiệm đã để sẵn kẽm.
3. Hiện tượng xảy ra phản ứng Zn và dung dịch HNO3 loãng
Mẩu kẽm tan dần, xuất hiện khí không màu NO hóa nâu trong không khí.
Tham khảo thêm:
Bài tập vận dụng về tác dụng Zn + HNO3
Ví dụ 1: Cân bằng phản ứng oxi hóa khử:
a) Zn + HNO3 → Zn(NO3)2 + N2O + H2O
b) Zn + HNO3 → Zn(NO3)2 + NO + N2 + H2O (tỉ lệ nNO:nN2=1:2)
c) Zn + HNO3 → Zn(NO3)2 + N2O + N2 + H2O (tỉ lệ nN2O:nN2=1:2)
Lời giải
a. 4Zn + 10HNO3 → 4Zn(NO3)2 + N2O + 5H2O
4x Zn − 2e → Zn2+
1x 2N+5 + 8e → 2N+1
b. 23Zn + 56HNO3 → 23Zn(NO3)2 + 2NO + 4N2 + 28H2O
23x Zn − 2e→ Zn2+
2 x 5N+5 + 23e → N+2 + 2N02
c/ 14Zn+34NO3→14Zn(NO3)2+N2O+2N2+17H2O
1x 6N+5 + 28e → 2N+1 + 2N02
14 x Zn −2e → Zn2+
Ví dụ 2: Cho 32 gam hỗn hợp MgO, Fe2O3, CuO tác dụng vừa đủ với 300ml H2SO4 2M. Khối lượng muối thu được là:
A. 60 gam
B. 85 gam
C. 80 gam
D. 90 gam
Lời giải:
Oxit + H2SO4→ Muối + H2O
0,6 mol 0,6 mol
BTKL: 32+ 0,6.98 = mmuối + 0,6.18
mmuối = 80 gam
Ví dụ 3: Cho dung dịch NH3 đến dư vào dung dịch chứa AlCl3 và ZnCl2 thu được kết tủa Z. Nung Z được chất rắn R. Cho luồng hiđro đi qua R nung nóng sẽ thu được chất rắn nào trong số các chất sau?
A. Zn và Al2O3.
B. Al và Zn.
C. Al2O3.
D. Al và ZnO.
Lời giải
AlCl3 + 3NH3 + 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3+ 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + NH3 dư → [Zn(NH3)6](OH)2
Chọn đáp án B
Sau khi đọc xong bài viết của chúng tôi các bạn có thể biết được Zn + HNO3 tạo ra chất gì và biết cách viết và cân bằng phương trình chính xác và nhanh chóng nhé


![Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O [Bài tập minh họa] Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + H2O [Bài tập minh họa]](https://kyniemsharp10nam.vn/wp-content/plugins/contextual-related-posts/default.png)