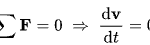Trong bài viết dưới đây, điện máy Sharp Việt Nam sẽ chia sẻ định nghĩa định luật bảo toàn nguyên tố là gì? Cũng như phương pháp bảo toàn nguyên tố trong hóa học kèm theo các dạng bài tập thường gặp có lời giải chi tiết để các bạn cùng tham khảo
Nội dung bài viết
Định luật bảo toàn nguyên tố là gì?
Định nghĩa định luật bảo toàn nguyên tố là các nguyên tố trong các hợp chất luôn được bảo toàn không mất đi mà chuyển từ hợp chất tham gia sang sản phẩm của nó.
Trong các phản ứng hóa học thông thường, các nguyên tố luôn được bảo toàn như vậy có nghĩa: Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng luôn bằng nhau.
Mở rộng: Tổng khối lượng các nguyên tố tạo thành hợp chất bằng khối lượng của hợp chất đó.
Phương pháp bảo toàn nguyên tố trong hóa học
Trong phản ứng hóa học, tổng số khối lượng của một nguyên tố trước phản ứng bằng tổng số khối lượng nguyên tố đó sau phản ứng.
Đối với bài toán hỗn hợp bao gồm nhiều chất xảy ra theo nhiều quá trình khác nhau mà đề bài chỉ cho các dữ kiện liên quan đến chất đầu tiên và chất cuối cùng ta lập sơ đồ sau đó tính toán theo sơ đồ (bỏ qua các phản ứng trung gian).
Khi áp dụng định luật bảo toàn nguyên tố ta chỉ cần viết sơ đồ phản ứng, không cần cân bằng phương trình hóa học.
Lưu ý:
Hạn chế viết phương trình phản ứng mà viết sơ đồ phản ứng biểu diễn sự biến đổi của nguyên tố đang cần quan tâm
Từ số mol của nguyên tố chúng ta quan tâm sẽ tính ra được số mol của các chất
Số mol nguyên tố trong hợp chất bằng số nguyên tử của nguyên tố đó trong hợp chất nhân với số mol hợp chất chứa nguyên tố đó
Giả sử ta có hợp chất AxBy có số mol là a (mol).
Khi đó số mol nguyên tố A và B trong hợp chất là:
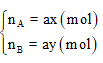
Tham khảo thêm:
- Công thức tính số mol, nồng độ mol của dung dịch chính xác 100%
- Khối lượng mol là gì? Công thức tính khối lượng mol chính xác 100%
- 10 cách cân bằng phương trình hóa học oxy hóa khử chính xác 100%
Các dạng bài tập về định luật bảo toàn nguyên tố thường gặp
Hầu hết tất cả các dạng bài tập đều có thể sử dụng phương pháp bảo toàn nguyên tố, đặc biệt là các dạng bài hỗn hợp nhiều chất, xảy ra biến đổi phức tạp. Dưới đây là một số dạng bài tập điển hình như:
Dạng 1: Từ nhiều chất ban đầu tạo thành một sản phẩm
Từ dữ kiện đề bài ⇒ số mol của nguyên tố X trong các chất ban đầu ⇒ tổng số mol trong sản phẩm ⇒ số mol sản phẩm
Hỗn hợp kim loại và oxit kim loại → hiđroxit kim loại → oxit
Al và Al2O3 + các oxit sắt → hỗn hợp rắn → hyđroxit → Al2O3 + Fe2O3
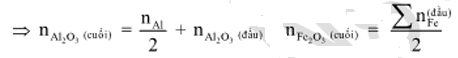
Ví dụ 1:Đốt cháy 4,16 gam hỗn hợp Mg và Fe trong khí O2, thu được 5,92 gam hỗn hợp X chỉ gồm các oxit. Hòa tan hoàn toàn X trong dung dịch HCl vừa đủ, thu được dung dịch Y. Cho dung dịch NaOH dư vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 6 gam chất rắn. Mặt khác cho Y tác dụng với dung dịch AgNO3 dư, thu được m gam kết tủa. Giá trị của m là
Lời giải
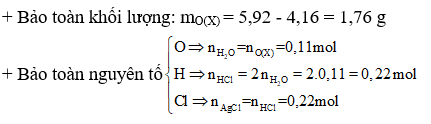
+ Tương tự như trên ta cần phải tính được nAg, nung Z thu được oxit có m = 6g > mX(5,92g)
⇒ Trong X phải có FeO,
Do đó khối lượng O dùng để oxi hóa Fe2+ trong X thành Fe3+ là:
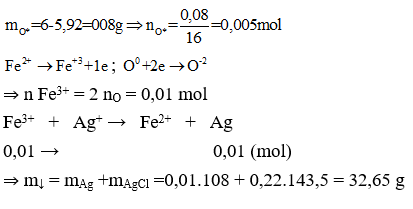
Ví dụ 2: Một hỗn hợp A gồm anđehit acrylic và một anđehit no, đơn chức X. Đốt cháy hoàn toàn 3,44 gam hỗn hợp trên cần vừa hết 4,592 lít khí oxi (đktc). Cho toàn bộ sản phẩm cháy hấp thụ hết vào dung dịch Ca(OH)2 dư, thu được 17 gam kết tủa. Công thức cấu tạo của X là:
Lời giải
Trước hết ta tính được tất cả những gì có thể tính được ngay:
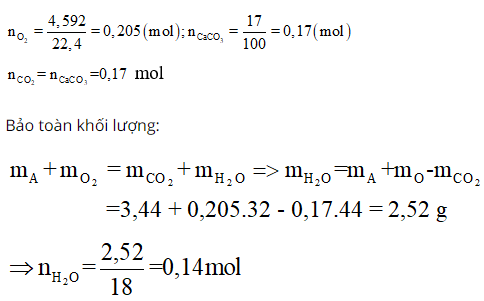
Anđehit đơn chức ⇒ do đó nA = nO(trong A)
+ Áp dụng định luật bảo toàn nguyên tố O, ta được:
nO(trong A) + 2nO(O2) = 2nCO2 + nH2O
nO(trong A) = 2.0,17 + 0,14 – 0,205.2 = 0,07 mol
⇒ nA = 0,07 mol
⇒ 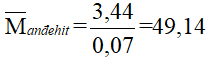
Vì anđehit acrylic CH2 = CH – CHO có phân tử khối là 56 nên suy ra được X < 49,14 ⇒ loại ngay đáp án C và D.
+ Vì X là anđehit no đơn chức nên có dạng CnH2nO ⇒ nCO2 = nH2O
Vì anđehit acrylic là anđehit có một nối đôi, đơn chức có công thức là C3H4O
nC3H4O = nCO2 – nH2O
Vậy nC3H4O = nCO2 – nH2O = 0,17 – 0,14 = 0,03 mol
Suy ra số mol của andehit X là
nX= nA – nC3H4O = 0,07 – 0,03 = 0,04mol
Gọi X là khối lượng phân tử của andehit X thì:
mA = 56.0,03 + 0,04.X = 3,44
⇒X = 44 ⇒ X là CH3CHO
Dạng 2: Từ một chất ban đầu tạo thành hỗn hợp nhiều sản phẩm
Từ dữ kiện đề bài ⇒ Tổng số mol ban đầu, số mol của các hợp phần đã cho ⇒ số mol chất cần xác định

Mặc dù có những biến đổi hóa học xảy ra trong quá trình cracking và Y thường là hỗn hợp phúc tạp ( có thể có H2), do phản ứng cracking xảy ra theo nhiều hương, với hiệu suất H < 100%. Nhưng ta chỉ quan tâm đến sự bảo toàn nguyên tố đối với C, H từ đó dễ dàng xác định được tổng lượng của 2 nguyên tố này

Ví dụ 1: Đốt cháy 9,8 gam bột Fe trong không khí thu được hỗn hớp rắn X gồm FeO,Fe3O4 và Fe2O3. Để toàn tan X cần dùng vừa hết 500ml dung dịch HNO3 1,6M, thu được V lít khí NO (sản phẩm khử duy nhất do ở đktc) Tìm giá trị của V
Lời giải
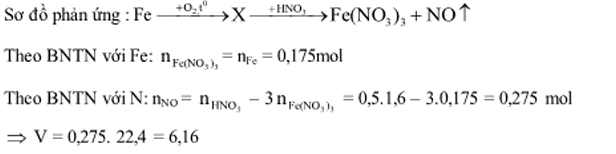
Dạng 3: Từ nhiều chất ban đầu tạo thành nhiều sản phẩm
Đối với dạng bài này không cần thiết phải tìm chính xác số mol của từng chất, chỉ quan tâm: ![]() ( chỉ quan tâm đến tổng số mol của các nguyên tố trước và sau phản ứng)
( chỉ quan tâm đến tổng số mol của các nguyên tố trước và sau phản ứng)
Ví dụ: Hòa tan m gam hỗn hợp X gồm FeO, Fe(OH)2, Fe(OH)3 trong dung dịch HNO3 vừa đủ thu được dung dịch Y và khí NO (sản phẩm khử duy nhất, đktc). Cô cạn dung dịch Y và lấy chất rắn thu được nung đến khối lượng không đổi thu được 30,4 gam chất rắn khan. Nếu cho 11,2 gam Fe vào dung dịch Y thu được dung dịch Z và p gam chất rắn không tan. p có giá trị bằng bao nhiêu?
Lời giải
Bảo toàn nguyên tố Oxi:
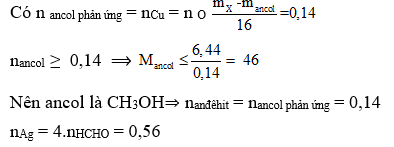
Ví dụ 2: Đốt cháy hoàn toàn 0,2 mol hỗn hợp gồm một ancol và một axit đơn chức có cùng số nguyên tố cacbon cần dùng 0,45 mol O2, thu được 0,4 mol CO2 và 0,5 mol H2O. Phần trăm khối lượng của axit trong hỗn hợp trên là:
A. 46,5% B. 32% C. 50% D. 49,18%
Lời giải

Hy vọng với những kiến thức về định luật bảo toàn nguyên tố mà chúng tôi vừa chia sẻ phía trên có thể giúp các bạn áp dụng vào làm bài tập nhé